在抗癌药物的研究中,那些正在开发的合成致死机制药物,主要针对晚期实体瘤进行临床试验。这一领域既带来了一线希望,也充满了众多挑战和疑问。
合成致死机制的原理
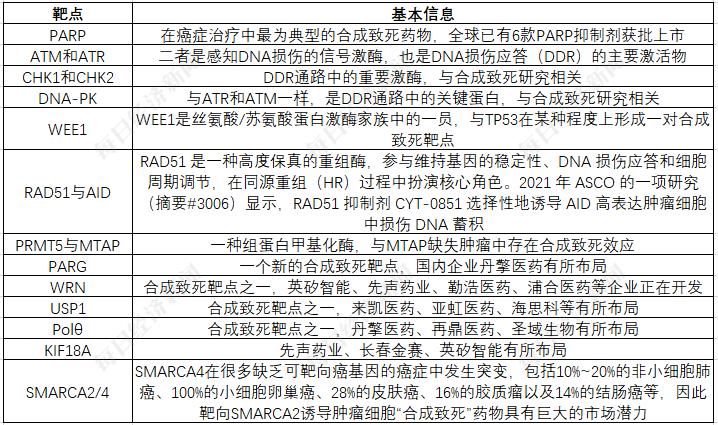
合成致死作用是通过独特的生物规律来对抗癌细胞的。癌细胞里常出现基因异常,比如某些基因存在缺陷。就好比一个精密的机器,若关键部件损坏,再破坏与之相关的部件,就能让整个系统崩溃。这种破坏可以在不影响正常细胞功能的前提下,有选择地消灭癌细胞。比如,2014年阿斯利康公司研发的PARP抑制剂奥拉帕利在美国获得批准,这正是合成致死机制的应用,仿佛开启了一扇全新的抗癌之门。
这类药物在发挥效用时,具有极强的针对性,并不针对所有晚期癌症患者。例如,它们仅对那些特定基因发生突变的特定癌症患者有效,就好比一把特制的钥匙只能打开特定的锁。这种精确性既是其优点,却也限制了其应用范围。
赛道投资热情被点燃的背后
奥拉帕利作为全球首个基于合成致死机制研发的抗癌药获得批准,立即引发了广泛关注和投资热潮。人们看到了抗癌新方法的巨大潜力。然而,并非所有项目都能一帆风顺。比如,WEE1靶点项目就遭遇了不少难题。一些行业人士开始担忧,在单靶点验证不足的情况下,直接挑战风险更高的双靶点是否明智。这好比建造房屋,地基未稳就急于加盖楼层,其中的风险显而易见。
许多公司如同寻宝者般争相进入这条赛道,无论规模大小,从行业巨头如百济神州、石药集团、先声药业,到新兴的小公司如英派药业、丹擎医药,都纷纷布局合成致死技术。各路企业都渴望在这片充满机遇的领域分得一杯羹。
不同靶点间的争议与问题
在研究合成致死机制的药物时,靶点问题常常是大家热议的焦点。以ATR和ATM为例,ATM主要针对DNA双链断裂的修复,而这种情况多见于放疗;ATR则专注于DNA单链断裂的修复,这与化疗有关。王波提出,两者作用机制各异,将它们结合起来的合理性尚待进一步研究。这种争论体现了合成致死机制药物研发的复杂性,就像将不同方向的拉力绳拧成一股,需要费劲地寻找平衡点。
新治疗机会与临床试验进展
2021年,AACR会议上,阿斯利康公布的新一代PARP抑制剂展现出更强的针对性。这种针对性的增强,就好比给子弹装上了精确的导航系统,有望减少PARP抑制剂的安全风险,并拓宽治疗领域。2022年3月,在中国启动的国际多中心I/IIa期临床试验PETRA计划招募了40名患者。到了2024年4月,又开展了一项3期临床研究,旨在评估其有效性和安全性。这些临床试验的进展,为合成致死机制药物的发展提供了实际的支持。
不良反应与化合物结构的关联
药物的不良反应可能与化合物的结构有关,而非合成致死机制本身。以PRMT5靶点为例,第一代抑制剂因毒性而限制了其疗效。就好比一个美好的想法,但在实施过程中出现了问题,导致效果不尽如人意。新一代PRMT5抑制剂通过结构改进,在MTAP缺失细胞系中或许能取得成功,这也表明从结构上改进以克服不良反应是一种可行的方法。
学术界与企业界的共同关注
合成致死现象近年来备受医药界关注。在2024年的分子靶点与癌症治疗研讨会上,BMS公司的一款药物在首次人体试验中公布了临床数据,并作为重要报告被口头展示。同时,先声药业的PRMT5抑制剂在临床前研究方面的成果也被选为AACR口头报告。这充分显示出学术界对其的高度重视。与此同时,企业界也并未懈怠,众多企业正积极进行管线布局。这一现象犹如理论与实践并肩前进,尽管前路未知,挑战重重,但探索与克服的决心未曾动摇。
各位,我有个疑问:在合成致死理论指导下,研发抗癌药物面临难题,我们最应该在哪个领域进行调整?期待大家在留言和点赞转发这篇文章的同时,也踊跃参与讨论。