铁死亡是细胞死亡的一种特殊方式,它与癌症治疗密切相关,关系复杂,既有带来希望的契机,也存在挑战,宛如一把双刃剑。
铁死亡的特征与启动因素
铁死亡具有显著特点,即铁依赖的脂质活性氧累积导致细胞死亡。这种现象在细胞内部,由多种因素共同作用。首先,细胞内谷胱甘肽主导的抗氧化机制受损,可能触发铁死亡。研究显示,当xCT等基因异常,影响谷胱甘肽水平时,便与铁死亡紧密相关。其次,铁的过量积累也能直接启动铁死亡。癌细胞的内部环境复杂多变,这些触发因素如同潜伏的导火索,随时可能引发铁死亡这一特殊细胞死亡方式。其发生并非孤立,而是细胞内众多部分相互作用的结果。
肿瘤细胞中铁死亡现象的特殊性同样不容忽视。我们发现,那些侵袭力强的肿瘤细胞,尤其是那些在常规治疗中仍然存活下来的细胞,更容易经历铁死亡。这一发现为癌症治疗研究开辟了新的路径,给科研人员带来了新的希望之光。
铁死亡在癌症疗法中的潜力与挑战
铁死亡作为一种细胞死亡方式,在肿瘤细胞中更为常见,这引起了研究人员对以铁死亡为基础的癌症疗法的关注。若这种疗法得以实现,将对癌症治疗领域产生重大变革。但实际情况并非如此简单。铁死亡在衰老和生长发育等生理活动中也扮演着新的角色。这一现象引发了人们对使用铁死亡诱导剂治疗癌症可能产生严重副作用的担忧,这些副作用可能干扰正常的生理功能。因此,在探索铁死亡应用于癌症治疗的道路上,充满了挑战和不确定性。
癌症治疗研究是个严谨的程序。每种疗法都必须经受严格测试和评价。铁死亡疗法虽理论上有巨大潜力,但与其他生理过程的潜在联系引发担忧,这限制了其发展。
PD-L1成为铁死亡敏感性标志物
研究肿瘤细胞在特定表型下对铁死亡的易感性,显得十分关键。有项关键研究通过生物信息学手段,对各种癌细胞系对铁死亡诱导剂的反应差异进行了分析。结果令人振奋,研究取得了重大突破。他们发现PD-L1是衡量铁死亡敏感性的关键细胞表面标志。这一发现对癌症治疗领域而言,具有里程碑式的意义。

该标志物的出现标志着我们能够更准确地辨别那些易受铁死亡影响的癌细胞。这无疑为后续的靶向治疗等相关研究打下了坚实的根基。研究过程中的每一次微小突破都极为不易,而这个标志物的发现或许将引领癌症治疗迈向全新的领域。
PD-L1促进铁死亡敏感性的机制
经过深入研究,我们了解到PD-L1在提升肿瘤细胞对铁死亡的敏感性上,起着至关重要的内在因果作用。具体来说,它是通过抑制相关表达并减少谷胱甘肽含量来提高这种敏感性的。这一机制的阐明,让我们对铁死亡与肿瘤细胞间关系的理解更深入了一层。
癌细胞内部,众多分子相互影响,构成了一张错综复杂的网络。当发现PD-L1在这张网络中的关键作用后,人们开始探索通过调整PD-L1的表达或相关途径,来改变肿瘤细胞对铁死亡的敏感度。这样,癌症治疗的新方法便有了可能。
构建PD-L1-ANC-IKE进行靶向治疗
研究团队发现,三阴性乳腺癌中PD-L1的表达水平较高,这促使他们尝试将铁死亡诱导剂针对这些高表达PD-L1的癌细胞。抗体-药物偶联物是进行靶向治疗的一个不错选择。然而,之前的研究并未探讨铁死亡诱导剂在类似药物中的应用。
研究团队采取了新方法,他们借助抗体纳米凝胶偶联物技术,成功搭建了PD-L1-ANC-IKE结构。他们将PD-L1抗体与纳米凝胶相结合,再将IKE包裹在纳米凝胶内。这种创新的结构具有显著特点,能够赋予IKE对PD-L1的特异性识别能力。
PD-L1-ANC-IKE的治疗优势
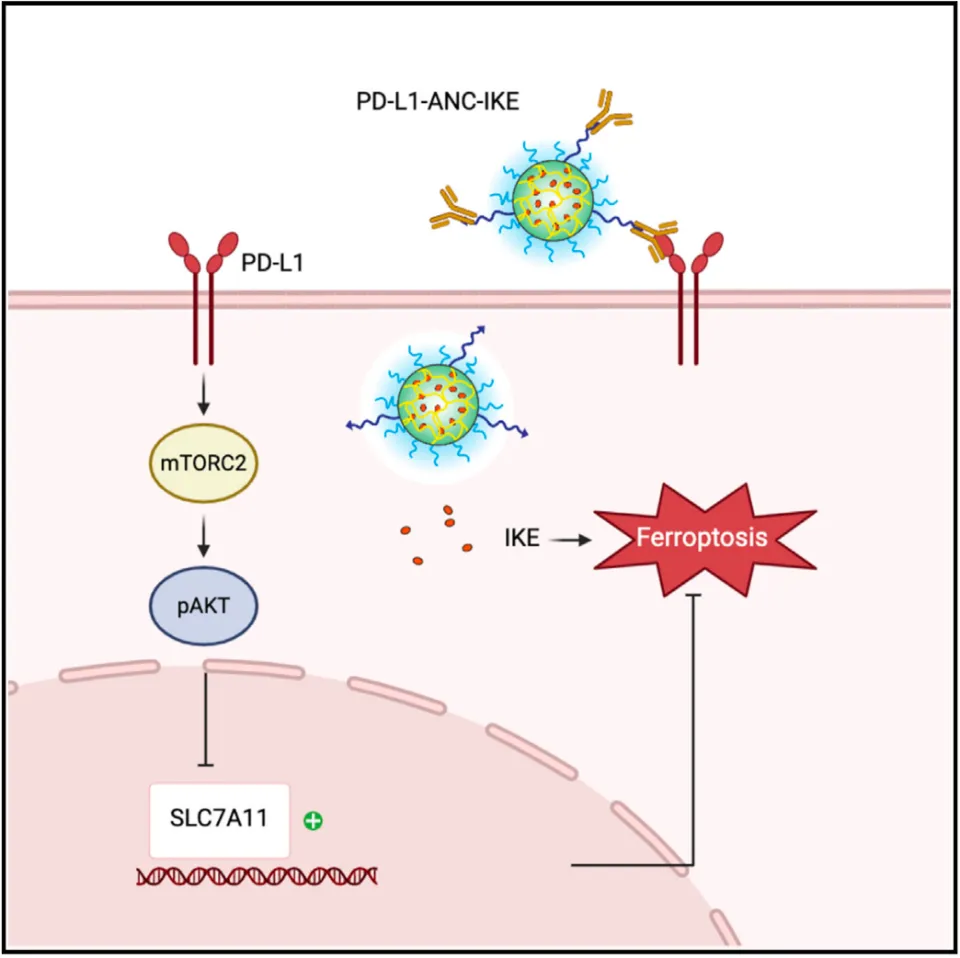
PD-L1-ANC-IKE的问世给癌症治疗带来了新的曙光。它能够通过诱导铁死亡有效遏制肿瘤在体外和体内的生长。更重要的是,这种疗法相较于全身给药的IKE,具有显著的优势。它能够提升IKE对肿瘤细胞的靶向递送,从而仅需较低的药物剂量即可获得显著的治疗效果。这不仅有助于减轻患者的身体负担,从药物成本的角度来看,也具有积极影响。
然而,我们能否仅凭PD-L1-ANC-IKE这一疗法彻底治愈癌症?期待大家留言交流各自的观点,同时别忘了给我们点个赞。